Основные понятия и аксиомы статики
Статика – учение о силах и условиях равновесия материальных тел, находящихся под действием сил.
Сила – мера механического взаимодействия тел. Совокупность сил, действующих на абсолютно твердое тело, называется системой сил.
Абсолютно твёрдое тело - совокупность точек, расстояния между текущими положениями которых не изменяются, каким бы воздействиям данное тело ни подвергалось.
Повышение температуры: чем выше температура, тем больше частиц имеет требуемую минимальную энергию или больше. Увеличение концентрации: чем выше концентрация партнеров по реакции, тем вероятнее, что частицы сталкиваются с соответствующей энергией. Поскольку в ходе реакции концентрация эдуктов уменьшается и концентрация продуктов увеличивается, скорость реакции уменьшается со временем. Оптимизация этих условий реакции особенно важна в промышленном и крупномасштабном масштабе.
Есть химические реакции, которые не являются полными. Даже если эдукты смешаны в стехиометрическом соотношении, эдукты все еще присутствуют в конце реакции. Если через некоторое время добавляют хлорид железа, образуется колодец цвета. Это означает, что все еще неиспользованный роданид калия. Таким же образом, депрессия цвета может быть достигнута добавлением калия-роданида.
В статике решаются две задачи :
1. Сложение сил и приведение систем сил, действующих на тело к простейшему виду;
2. Определение условий равновесия действующих на тело систем сил.
Две системы сил называются эквивалентными , если они оказывают одинаковое механическое воздействие на тело.
Система сил называется уравновешенной (эквивалентной нулю), если она не изменяет механического состояния тела (то есть состояния покоя или движения по инерции).
Хлорид водорода реагирует с водой почти полностью в кислотно-щелочной реакции. В конце реакции молекулы соляной кислоты не присутствуют, а только хлорид ионы оксония в качестве продуктов. Хлорид водорода практически полностью диссоциирует в воде, степень диссоциации составляет 100%. Эту смесь называют соляной кислотой.
Наблюдения такого рода привели к понятию обратимых химических реакций и химического равновесия. В принципе, все химические реакции являются обратимыми, продукты могут реагировать обратно на реагенты. Реакция реагентов на продукты называется реакцией, которая возвращается из продуктов обратно в реагенты.
Равнодействующей силой называется одна сила, если она существует, эквивалентная некоторой системе сил.
Силы, линии действия которых пересекаются в одной точке, называют сходящимися .
1. Аксиома о равновесии системы двух сил . Под действием двух сил, приложенных к абсолютно твердому телу, тело может находиться в равновесии тогда и только тогда, когда эти силы равны по величине и направлены вдоль одной прямой в противоположные стороны (рис. 1.1).
Определение прямой реакции соответствует направлению чтения слева направо. Обратная реакция затем соответствует направлению обратного считывания. Уксусная кислота реагирует с водой в обратимой реакции с образованием ацетата и ионов оксония. Реакция хлорида железа с роданитом калия на железный роданит. . Если условия испытаний не изменяются для обратимых реакций, химическое равновесие происходит через некоторое время. Концентрации исходных материалов и продуктов больше не меняются, хотя реакция спины и спины все еще продолжается.
Эти неизменные равновесные концентрации находятся в соотношении, характерном для реакции и условий реакции. Химическое равновесие, константу равновесия, кислотную константу, постоянство массового эффекта, закон массового действия и равновесие течения. В случае, по-видимому, полных реакций, таких как, например, хлористый водород в воде, равновесие практически находится на стороне продуктов. Реакция благоприятна, и реакция практически отсутствует.
Рисунок 1.1
2. Аксиома о добавлении (отбрасывании) системы сил, эквивалентной нулю . Действие данной системы сил на абсолютно твердое тело не
изменится, если к ней прибавить или отнять уравновешенную систему сил (т.е. эквивалентную нулю).
Имеем систему ![]() ; добавим
; добавим ![]() 0
0
Для реакции уксусной кислоты с водой равновесие находится на стороне эдуктов. Здесь обратная реакция оказывает более сильное влияние на положение равновесия, чем прямая реакция. Для реагентов, которые не реагируют друг с другом, равновесие практически завершается со стороны исходных материалов.
Существуют различные типы химических реакций. Реакция осаждения реакционной кислотой реакции реакции окислительно-восстановительной реакции и реакции лиганда с обменом химическим добавлением и замещением гидролиза. Кроме того, две молекулы объединяются в одну.
Получим ![]() {
{ ![]() ;
; ![]() }.
}.
Следствие: При переносе силы вдоль её линии действия, действие этой силы на тело не меняется. Из этого следствия вытекает, что сила приложенная к абсолютно твёрдому телу представляет собой скользящий вектор.
Когда происходит конденсация, две молекулы соединяются вместе, образуя небольшие молекулы, такие как вода или аммиак. В соответствии с агрегированным состоянием соответствующих веществ реакции газовых реакций в реакциях раствора в растворе в реакциях поверхностных реакций в расплаве. В зависимости от природы реагирующих частиц или механизмов реакции, ионные реакции, радикальные реакции, молекулярные реакции, реакции комплексообразования. Схема реакции символического представления уравнения переходного состояния Колмогорова для математического описания химических реакций с температурой диффузии и насыщения.
- В соответствии с реакциями класса или связывания.
- Майкл Вахтер: вещества, частицы, реакции.
Пусть в точке А твердого тела приложена сила (рис.1.2). К этой силе на ее линии действия в точке В в соответствии с аксиомой II добавим систему сил , эквивалентную нулю, для которой . Выберем силу , равную силе .

Рисунок 1.2
Полученная система трех сил эквивалентна, согласно аксиоме о добавлении равновесной системе сил, силе , то есть .
Разграничение физических процессов
Герхарт Джандер: Введение в неорганически-химическую лабораторию. . В случае химической реакции образуется по меньшей мере одно новое вещество - в случае физических процессов специфические для вещества, но только физические свойства, такие как теплосодержание и расширение, не изменяются. Наблюдается наблюдение за выбросами или поглощением энергии, изменениями состояния агрегата или цвета. Однако независимо от того, что здесь сказано, реакции можно также описать средствами.
Все другие типы реакций могут быть синтезированы из анализа и синтеза. Здесь элемент реагирует на соединение, в результате чего возникает другой элемент и новое соединение. Вода хлора реагирует аналогично раствору бромида натрия; прикрепленный гексан, затем превращается в оранжевый вместо розавиолета.
Система сил , согласно аксиоме 1, эквивалентна нулю, и согласно аксиоме 2 ее можно отбросить. Получится одна сила , приложенная в точке В , то есть . Окончательно получаем . Сила приложена в точке А . Она эквивалентна такой же по модулю и направлению силе , приложенной в точке В , где точка В – любая точка линии действия силы . Теорема доказана: действие силы на твердое тело не изменится от переноса силы вдоль линии действия. Силу для твердого тела можно считать приложенной в любой точке линии действия, то есть сила – скользящий вектор. Как скользящий вектор сила характеризуется: численным значением (модулем) ; направлением силы ; положением линии действия силы на теле.
Последовательность эндотермической реакции
При связывании контрастов, возникающих из соединений и соединения и элемента. . Таким образом, восстанавливающий агент в качестве донора электронов испускает по меньшей мере один электрон окисляющему агенту в качестве акцептора электронов. Постоянно подавая определенное количество энергии, сумма и, система поднимается в неустойчивое состояние.
В общем балансе химическая система поглощает энергию из окружающей среды, ее называют. Примером эндотермической реакции является реакция на сульфид меди и из него. Другими примерами являются реакция железа и серы на одноразмерный сульфид и т.д. металлы и сера всегда реагируют на сульфиды металлов.
3.Аксиома параллелограмма сил. Две силы , приложенные в одной точке абсолютно твердого тела, имеют равнодействующую силу , приложенную в той же точке и равную геометрической (векторной) сумме этих сил (рис.1.3).
![]()

Обратимые реакции - Равновесные реакции
Пример: Сжигание угля занимает больше времени, чем сгорание того же количества угольного порошка, который вдувается в поток воздуха. Пример: Углерод ожога в чистом кислороде быстрее, чем в том же количестве воздуха. Повышает концентрацию реакционных партнеров. . Реагирует с водой почти полностью в одном. После реакции молекулы соляной кислоты остаются, а только хлорид и продукты. Хлорид водорода практически полностью диссоциирует в воде, его содержание составляет 100%.
Эти неизменные равновесные концентрации находятся в соотношении, которое характерно для реакции и условий реакции. Символическое представление реакции. Герхарт Джандер: Введение в неорганическую химическую практику. . И образует стабильные оксиды почти со всеми элементами периодической системы. Реакции, связанные с кислородом, такие как сжигание угля или углеводов, являются важными процессами в природе и технологии. Такие процессы называются реакциями окисления.
Рисунок 1.3
Следствие: Теорема о трех не параллельных силах: Если под действием трех сил тело находится в равновесии и линии действия двух сил пересекаются, то все силы лежат в одной плоскости и их линии действия пересекаются в одной точке.

Рисунок. 1.4
Кислород и наиболее распространенный оксид элемента, вода, делают жизнь на земле возможной. Но также многие технические материалы, такие как стекло, керамика или руды, являются оксидами. Реакция окислов с водой дает либо кислоты, либо основания. Атом кислорода имеет 8 протонов и обычно 8 нейтронов в атомном ядре, а также 8 электронов в атомной оболочке. На первой электронной оболочке и на шести электронах на второй электронной оболочке два электрона, так что кислород имеет шесть внешних электронных электронов.
Чтобы добиться стабильного расположения электронов, восемь оболочек неонов, атом кислорода, должны принимать два электрона от связывающих партнеров. С более электроотрицательными неметаллами, такими как углерод или сера, электронный кокет достигается за счет образования полярных атомных связей. Кислородные атомы также могут входить в атомные связи и, таким образом, образуют молекулы. Обычным видом является двухатомный диоксид, который содержится в воздухе примерно до 21 об.%. Два атома в молекуле диоксигена соединены двумя общими электронными парами.
Положим, что тело находится в равновесии под действием трех сил , 3 , приложенных в точках А, В, С (рис.1.4). По 3 аксиоме равнодействующая первых двух сил может быть найдена по правилу параллелограмма, построенного на силах 1 и 2, перенесенных вдоль линии их действия в точку О пересечения последних, т. е. . Согласно первой аксиоме статики для равновесия тела необходимо и достаточно, чтобы сила 3 была уравновешивающей двух первых сил. Это возможно только в том случае, когда силы и 3 лежат на одной прямой и имеют противоположные направления. Но тогда линии действия сил , 3 пересекутся в одной точке О. Любая из трех данных сил уравновешивает две другие. Выведенное условие равновесия трех не параллельных сил является необходимым, но не достаточным. Если линии действия трех сил пересекаются в одной точке, то отсюда вовсе не следует, что эти три силы представляют собой уравновешенную систему сил.
Каждый атом кислорода по-прежнему имеет четыре несвязанных электрона, час две свободные пары электронов. Удивительно, что молекулярный кислород парамагнитен. Согласно простой идее, что два атома кислорода связаны двумя электронными парами в двойной связи в молекуле, следует ожидать диамагнетизма.
Элемент кислорода - бесцветный, без запаха, газ. Сам кислород не горючий, но способствует горению. Это жизненно важный компонент воздуха, поскольку он необходим для биохимического процесса дыхания. Второй модификацией кислорода является озон, который состоит из угловых молекул О 3.
4. Аксиома о равенстве сил действия и противодействия. При всяком действии одного тела на другое имеет место такое же численно, но противоположное по направлению противодействие (III закон Ньютона). Силы взаимодействия двух тел не составляют систему уравновешенных сил, так как приложены к разным телам.

Озон - голубоватый, ядовитый газ, характерный запах которого, Например, хорошо в копировальных машинах. Он очень быстро разлагается до кислорода, когда он снабжается энергией. Образование озона из кислорода является эндотермическим. Вблизи от земли выхлопные газы автомобилей приводят к образованию озона, который является основным источником летнего смога. Здесь это нежелательно, потому что он раздражает глаза и слизистые оболочки и повреждает органы дыхания.
Кислород является типичным неметаллическим. Поскольку атомные связи в молекуле кислорода относительно сильны, газ реагирует при комнатной температуре только с несколькими партнерами реакции, Например, базовые металлы или фосфор. Однако при более высоких температурах оксиды различного состава образуются в виде соединений элементов-кислорода практически со всеми элементами. Обычно экзотермическая реакция известна как горение, и во многих случаях она очень сильная, как реакция кислородного водорода между водородом и кислородом.
Рисунок 1.5
5. Аксиома о связях. Материальные объекты (тела и точки), которые ограничивают свободу перемещения рассматриваемого твердого тела, называются связями. Сила, с которой связь действует на тело, препятствуя его перемещению, называется реакцией связи. Реакция связи направлена противоположно возможному перемещению тела. Аксиома связей утверждает, что всякую связь можно отбросить и заменить силой или системой сил (в общем случае), то есть реакциями связи.
Не только другие элементы, но и многие соединения реагируют с выделением тепла кислородом. Реакцию вещества с кислородом обычно называют окислением. Однако в современной химии термин «окисление» больше не ограничивается добавлением только кислорода. Кислород происходит в воздухе около 21 об.%. В неорганических соединениях кислород образуется в форме силикатов, карбонатов в породах или оксидах, Песок и вода. При доле почти 50% кислород является самым распространенным элементом земной коры. Многие органические соединения, такие как углеводы, спирты или карбоновые кислоты, также содержат кислород в молекуле.
6. Аксиома затвердевания. Равновесие деформируемого тела, находящегося под действием данной системы сил, не нарушится, если тело считать отвердевшим (абсолютно твердым). Если деформируемое тело находилось в равновесии, то оно будет находиться в равновесии и после его затвердевания.
Основные виды связей и их реакции
Приведем примеры связей для плоской системы сил и их замены силами реакций связей.
Помимо водорода, кислород может быть извлечен путем электролитического разложения воды. Еще одной возможностью получения чистого кислорода является разжижение воздуха и отделение компонентов азота и кислорода путем дистилляции при низких температурах.
Например, в медицине в респираторных устройствах. При смешивании с горючими газами газ используется для сварки и пламенной резки. Кислород используется для производства стали из чугуна. Выдувая кислород в жидкий чугун, углерод и другие мешающие примеси окисляются и удаляются. Он также необходим для реакций окисления в органической химии. Жидкий кислород используется в качестве ракетного топлива. Он также используется для отбеливания и биологической очистки сточных вод.
1. Гладкая поверхность (рис.1.6,а). Если тело опирается на идеально гладкую поверхность, то реакция поверхности направлена по нормали к общей касательной поверхностей тел в точке соприкосновения.
2. Подвижная шарнирная опора, подвижный шарнир – опора, поставленная на катки, не препятствующие перемещению тела параллельно опорной плоскости. Реакция подвижного шарнира направлена по нормали к поверхности, на которую опираются катки шарнира (рис.1.6,б).

|
|
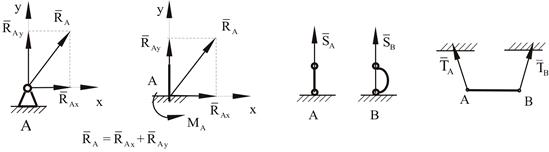
3. Неподвижная шарнирная опора, неподвижный шарнир – совокупность неподвижного валика и надетой на него втулки с твердым телом, вращающимся вокруг оси (подшипник, петля). Реакция неподвижного шарнира проходит через ось валика, в неизвестном направлении, поэтому определяют две ее составляющие, направленные параллельно осям координат, перпендикулярных оси валика (рис. 1.6, в).
4. Жесткая заделка – жестко закрепленная балка, стержень. Связь препятствует любому движению конца балки. Для определения реакции жесткой заделки необходимо определить составляющие главного вектора R А, направленные параллельно осям координат и главный момент М А заделки (рис. 1.6, г).
5. Стержень – жесткий невесомый стержень, концы которого соединены с другими частями конструкции шарнирами. Реакция направлена по линии, проведенной через опорные шарниры стержня (рис. 1.6, д).
6. Гибкая связь – нить, цепь, трос. Реакция приложена к твердому телу в точке соприкосновения и направлена по связи (рис. 1.6, е).
Связи и реакции связей
Тело называется свободным , если его перемещение в пространстве ничем не ограничено. В противном случае тело называется несвободным , а тела, ограничивающие перемещения данного тела, связями . Силы, с которыми связи действуют на данное тело, называются реакциями связей .
Основные виды связей и их реакции:
Реакция гладкой поверхности направлена по нормали к этой поверхности (перпендикулярна общей касательной).

Реакция перпендикулярна опирающейся поверхности.
Идеальная нить (гибкая, невесомая, нерастяжимая):
П римеры:
моделирует трос, канат, цепь, ремень,…
римеры:
моделирует трос, канат, цепь, ремень,…
Реакция идеальной нити направлена по нити к точке подвеса.
Идеальный стержень (жесткий, невесомый стержень, на концах которого шарниры):

Реакция связи направлена по стержню.
В отличие от нити стержень может работать и на сжатие.
Цилиндрический шарнир:
Такая связь позволяет телу перемещаться вдоль оси, поворачиваться вокруг оси шарнира, но не позволяет точке закрепления перемещаться в плоскости, перпендикулярной оси шарнира. Реакция лежит в плоскости, перпендикулярной оси шарнира, и проходит через нее. Положение этой реакции не определено, но она может быть представлена двумя взаимно перпендикулярными составляющими
Аксиома освобождаемости от связей:




